
酸化還元活性な複素環補酵素の性質と機能制御
ルテニウム(II)錯体におけるπ逆供与を利用して、ルテニウムーTPAユニット上に配位した複素環補酵素の酸化還元挙動について、詳細に調べることができる。すなわち、ルテニウム-TPAユニットをプラットフォームとして、配位複素環補酵素の性質、反応性を理解することを目的としている。これまでに、複素環補酵素として、プテリンとフラビンに注目し、それらのプロトン共役電子移動過程におけるラジカル中間体の検出と電子状態の解明、それら補酵素の酸化還元電位の非共有結合性相互作用による制御、フェノール類からRu(III)-プテリン錯体へのプロトン共役電子移動による水素移動反応、などについて研究を行ってきた。
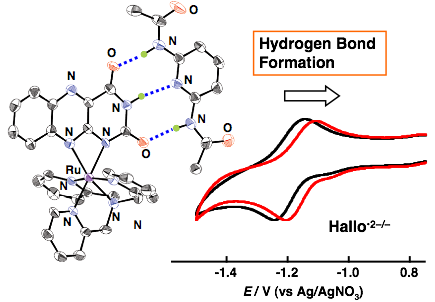
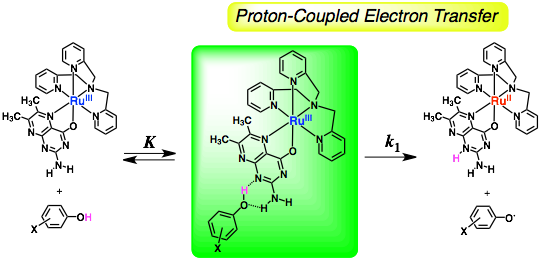
図.フェノール類からRu(III)-プテリン錯体への水素移動反応 (JACS 2009, 131, 11615)。
文献
Angew. Chem. Int. Ed. 2003, 42, 4951; Angew. Chem. Int. Ed. 2007, 46, 905 (Selected as a VIP paper); Inorg. Chem. 2008, 47, 333; J. Biol. Inorg. Chem. 2008, 13, 321 (Accounts); Angew. Chem. Int. Ed. 2008, 47, 9669; J. Am. Chem. Soc. 2009, 131, 11615.
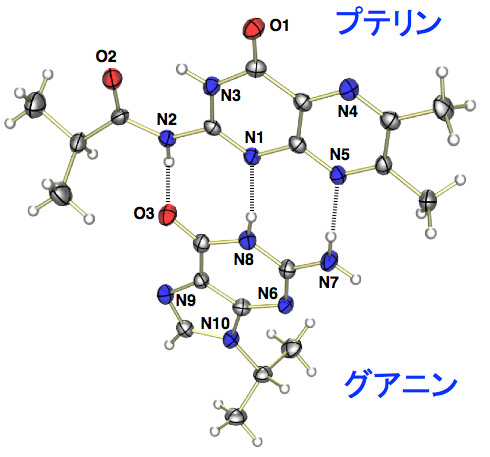
プテリンの反応性の制御は、周辺アミノ酸残基との水素結合等の非共有結合性相互作用によって行われていると考えられてきたが、具体的な証明はなされていなかった。そこで、Ru(II)-プテリン錯体におけるプテリン配位子の酸化還元電位が、分子間水素結合によりどのように制御されるかを検討した。水素結合の相手として、4種の核酸塩基(A, T, C, G)を用いた。プテリンはグアニンと相補的な3点水素結合を形成し、その水素結合により、酸化還元電位が320 mVも高電位シフトした(Angew. Chem. Int. Ed. 2012, 51, 4623)。プテリンはグアニンから生合成されることを考えると、感慨深いものがある。
図.Ru(II)-アロキサジン錯体における水素結合形成と酸化還元電位の制御 (ACIE 2007, 46, 905)。
_
